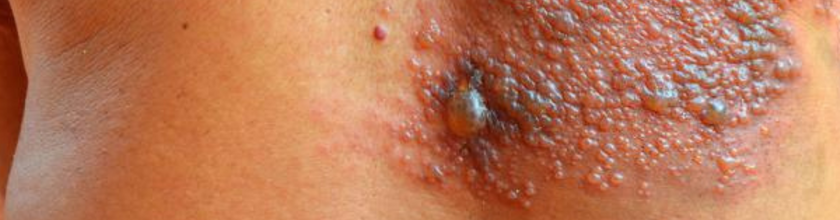
Herpes Zóster
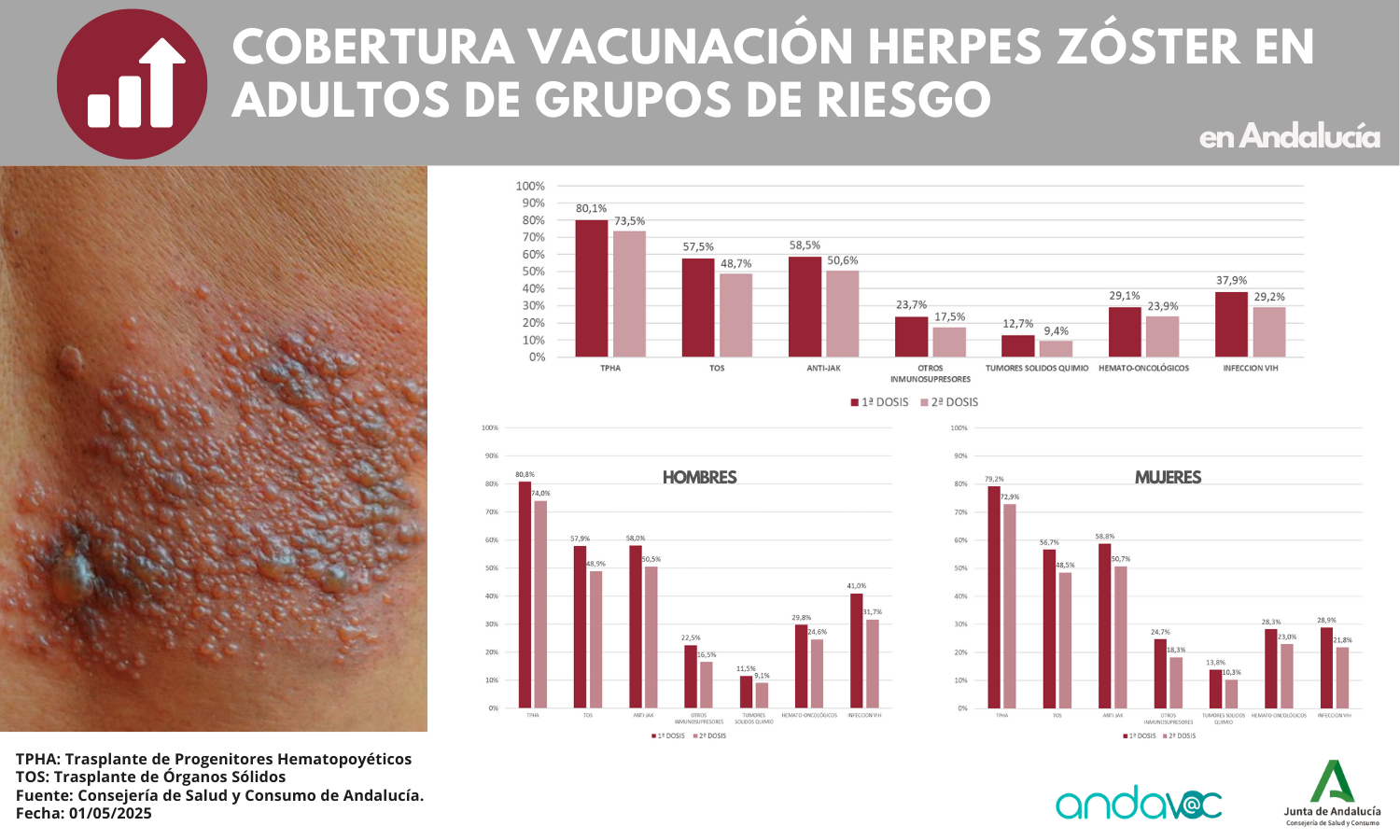
Vacunación en grupos de riesgo
Documentación técnica
Vacunación frente a Herpes Zóster en Andalucía. Instrucción DGSPyOF-4/2024 (cambios resaltados)
Dirección General de Salud Pública y Ordenación Farmacéutica.
Consejería de Salud y Consumo.
- Fecha creación/actualización: 13 mayo 2024
- Tamaño documento: 1,7 MB
- Acceder al documento
Vacunación frente a Herpes Zóster en Andalucía. Instrucción DGSPyOF-4/2024
Dirección General de Salud Pública y Ordenación Farmacéutica.
Consejería de Salud y Consumo.
- Fecha creación/actualización: 13 mayo 2024
- Tamaño documento: 1,8 MB
- Acceder al documento
Vacuna frente a herpes zóster (Shingrix). Ficha técnica en castellano
Ficha técnica o resumen de las características del siguiente medicamento:
Shingrix polvo y suspensión para suspensión inyectable
Vacuna frente al herpes zóster (recombinante, adyuvada)
- Fecha creación/actualización: No especificada
- Tamaño documento: 512 KB
- Acceder al documento
Vídeo preparación y administración de la vacuna SHINGRIX frente al Herpes zóster
Dirección General de Salud Pública y Ordenación Farmacéutica.
Consejería de Salud y Consumo.
- Fecha creación/actualización: 15 julio 2024
- Tamaño documento: 22,4 MB
- Acceder al documento
Preguntas frecuentes
Shingrix® puede ser administrada en personas que previamente se han vacunado frente a herpes zoster con la vacuna Zostavax®. En general, se recomienda un intervalo de 5 años desde que se administró Zostavax®, aunque puede considerarse un intervalo menor a 5 años si el paciente tenía más de 70 años cuando recibió Zostavax®.
En cuanto a la pauta, se recomienda administrar una pauta completa de Shingrix®, es decir, de 2 dosis.
Fuente de información:
Fecha de elaboración de la respuesta: 29 enero 2025
Idealmente se administrará la primera dosis al menos 10 días antes de iniciar el tratamiento antitumoral.
Si esto no es posible, se buscarán períodos ventana de menor inmunosupresión y estabilidad de la patología para su administración, cuándo es más probable que la respuesta inmunitaria sea mayor.
Mas información:
Fecha de elaboración de la respuesta: 29 mayo 2023
Idealmente la primera dosis se administrará al menos 10 días antes de iniciar el primer ciclo de quimioterapia o cualquier tratamiento inmunosupresor.
Si esto no es posible, se buscarán períodos ventana de menor inmunosupresión y estabilidad de la patología para su administración, cuando es más probable que la respuesta inmunitaria sea mayor.
Fecha de elaboración de la respuesta: 29 mayo 2023
Si el paciente presenta CD4 ≥200/µl no es necesario esperar ningún periodo de tiempo para la vacunación. Si el paciente presenta CD4 <200/µl, se valorará individualmente el momento de la vacunación.
En general, en pacientes con diagnóstico en estadio precoz y tras el inicio del tratamiento antirretroviral, se espera una mejoría del estado inmunitario con un incremento en el recuento de CD4 en los primeros 3 meses, pudiendo retrasar la administración de la primera dosis a cuando se prevé una mejor respuesta inmunitaria (CD4 ≥200/µl).
No se recomienda demorar la vacunación en pacientes con VIH avanzado/SIDA o si se prevé un retraso significativo.
Fecha de elaboración de la respuesta: 29 mayo 2023
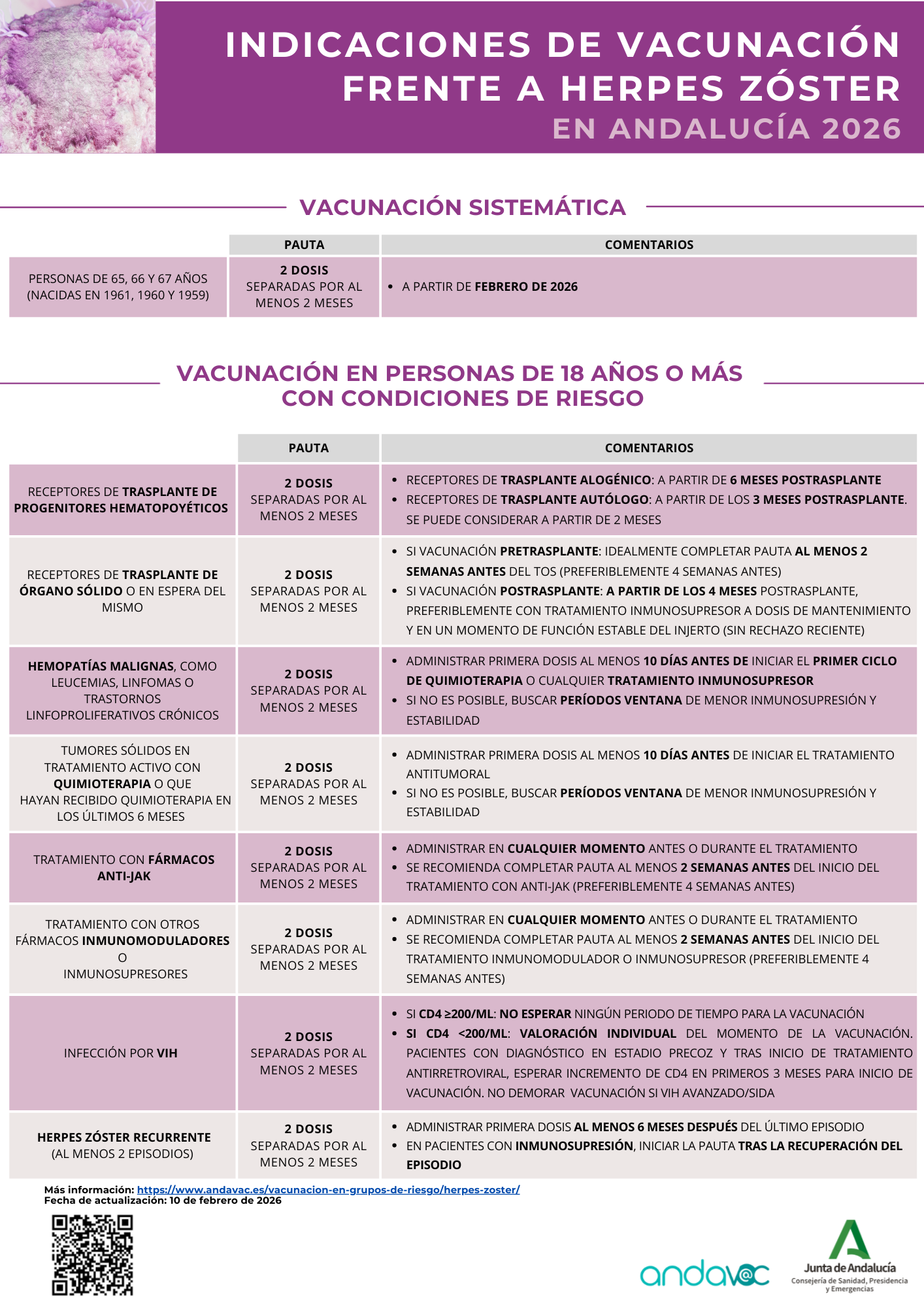
Actualmente en Andalucía, pueden recibir la vacuna frente al herpes zóster (Shingrix®) las personas de 18 años o más con alguna de las siguientes situaciones:
- Trasplante de progenitores hematopoyéticos (TPH), en las siguientes circunstancias:
- Si han pasado menos de 24 meses desde el TPH.
- Independientemente desde el tiempo transcurrido del TPH:
- Si recibe tratamiento inmunosupresor.
- Si desarrolla enfermedad injerto contra huésped (EICH).
- Trasplante de órgano sólido (TOS) o en espera del mismo
- En tratamiento con fármacos anti-JAK. Ejemplos: tofacitinib (Xeljanz®), baricitinib (Olumiant®), upadacitinib (Rinvoq®), ruxolitinib (Jakavi®), filgotinib (Jyseleka®), abrocitinib (Cibinqo®).
- Infección por VIH.
- Hemopatías malignas, como leucemias, linfomas o trastornos linfoproliferativos crónicos.
- Tumores sólidos en tratamiento activo con quimioterapia o que hayan recibido quimioterapia en los últimos 6 meses.
- Antecedente de dos o más episodios de herpes zóster.
- Tratamiento con otros fármacos inmunomoduladores o inmunosupresores.
A partir del 15 de mayo de 2024. se introduce como novedad la vacunación sistemática frente a herpes zóster a la cohorte de 65 años (en 2024, los nacidos en 1959). A partir del 1 de marzo de 2025 se incluye la cohorte de 1960.
Durante 2026, se vacunarán las personas nacidas en 1961 y se realizará rescate de las personas nacidas en 1959 o 1960 (67 y 66 años respectivamente) no
vacunadas aún.
Las personas con estos criterios pero que tienen consideración de mutualistas y que han optado por el aseguramiento privado, deberán seguir el procedimiento que les indiquen las entidades a las que estén adscritas para recibir dicha vacunación.
Fuente de la información:
Fecha de elaboración de la respuesta: 27 enero 2026
Se indica la vacunación frente al HZ (Shingrix®) en personas de 18 años o más, en tratamiento con estos fármacos:
- Terapias dirigidas frente a células B (como alemtuzumab, ibritumomab, obinutuzumab, ocrelizumab, ofatumumab, rituximab, daratumumab, isatuximab, brentuximab, inotuzumab o polatuzumab).
- Anti-BLyS (como belimumab).
- Agonistas del receptor de integrina (como natalizumab o vedolizumab).
- Anticuerpos monoclonales frente al receptor de IFN-I (como anifrolumab).
- Anti-TNF-alfa (como adalimumab, certolizumab, etanercept, golimumab o infliximab).
- Moduladores de la coestimulación de células T (como abatacept o belatacept).
- Moduladores del receptor de la esfingosina-1-fosfato (como fingolimod, ozanimod, ponesimod o siponimod).
- Inhibidores de interleuquinas, como: Anti-IL-6 (como sarilumab, satralizumab, siltuximab o tocilizumab). Anti-IL-17 (como ixekizumab, bimekizumab, brodalumab o secukinumab). Anti-IL-12/23 (como ustekinumab). Anti-IL-23 (como guselkumab, risankizumab o tildrakizumab). Anti-IL-1 (como anakinra o canakinumab).
- Otros agentes antineoplásicos, inmunomoduladores o inmunosupresores: cladribina, elotuzumab, lenalidomida, dimetilfumarato, ciclofosfamida, ciclosporina, tacrolimus, everolimus, leflunomida, teriflunomida.
- Corticoides sistémicos a dosis moderadas-altas (equivalente a ≥20 mg/día de prednisolona) durante más de 10 días en el mes previo; corticoides sistémicos a dosis moderadas (equivalente a ≥10 mg/día de prednisolona) durante más de 4 semanas en los tres meses previos.
- Otros fármacos como metotrexato >20 mg/semana (oral o subcutáneo), azatioprina >3 mg/kg/día, 6-mercaptopurina >1,5 mg/kg/día o micofenolato >1 g/día en los tres meses previos.
- Así como otras combinaciones terapéuticas en los 3 meses previos de fármacos inmunosupresores o inmunomoduladores con dosis individuales inferiores a las a las indicadas en los dos puntos anteriores (por ejemplo, combinación de ≥7,5 mg de prednisolona por día o cualquier dosis de metotrexato con leflunomida).
Fuente de información:
Fecha de elaboración de la respuesta: 14 noviembre 2023
Como profesional de la salud, envíanos tu pregunta acerca de la vacunación frente al Herpes Zóster
Si tras consultar el banco de preguntas de esta página tienes alguna duda sobre las vacunas o el proceso de vacunación frente al Herpes Zóster llevado a cabo en los centros sanitarios de Andalucía, envíanosla a través de este formulario.
La valoraremos en el equipo de Andavac para incorporarla o para modificar y mejorar las preguntas-respuestas frecuentes incluidas en el catálogo.